CIENCIAS III
EXAMEN FINAL
Subraya la respuesta correcta de cada planteamiento.
1.- Le lo siguiente:
I. La densidad del hielo le permite flotar sobre el agua liquida
II. El agua reacciona con diversas sustancias formando nuevos compuestos
III. El agua es un compuesto que se puede encontrar en un estado líquido, sólido o gaseoso
IV. Debido a su alto calor específico el agua absorbe e irradia gran cantidad de calor
V. El agua es un compuesto estable para disociar su molécula se necesitan temperaturas superiores a los 2500 ºC
Dos de los enunciados anteriores no corresponden a las características físicas del agua ¿cuales son?
A) I y II
B) I y III
C) II y V
D) II y IV
2.- Lee con atención:
La disolución de un electrolito conduce la corriente eléctrica porque esta formada por iones positivos llamados____________ e iones negativos llamados_____________ que pueden moverse fácilmente en el liquido
¿Cuál pareja de las siguientes palabras completa correctamente el texto anterior?
A) ánodos, cátodos
B) cátodos, ánodos
C) cationes, aniones
D) aniones, cationes
3.- De los siguientes enunciados ¿cual no se refiere a una de las propiedades consideradas como ácidos?
A) Tienen un sabor amargo característico
B) Colorean de rojo la tintura de tornasol azul
C) Pueden disolver a la piedra caliza liberando gas en la reacción
D) Al ponerse en contacto con algunos metales, como el zinc, producen efervescencia
4.- De las siguientes reacciones de oxidación, ¿cuál de ellas corresponde a un oxido básico?
A) C + O2 → CO2
B) 2Ca + O2 → 2CaO
C) 2S + 3O2 → 2SO3
D) P4 + 5O2 → 2 P2O5
5.- Es el principal compuesto que interviene en el “efecto invernadero”, que tiene como consecuencia el aumento de la temperatura en la tierra
A) dióxido de azufre
B) dióxido de carbono
C) monóxido de plomo
D) monóxido de nitrógeno
6.- De los siguientes compuestos, ¿cuales son los principales productos en la combustión completa de una vela?
A) H2O y CO2 obtenidos
B) HCl y CO
C) H2S y NH3
D) NO2 y COOH
7.-Otros elementos y/o compuestos que intervienen en el proceso de la corrosión de los metales, además de la reacción entre el oxigeno y el hierro son:
A) el CO y el N
B) el CO2 y el H
C) el CO y el NH3
D) el CO2 y H2O
8.-observa la siguiente formula semidesarrollada:
CH3 CH2 CH2 OH
¿Cuál es el nombre de este compuesto?
A) Etano
B) Etanol
C) Propano
D) Propanol
9.- ¿Cuál es el numero de oxidación del cromo (Cr) en el compuesto K2+1Cr2O7-2?
A) -6
B) +6
C) -12
D) +12
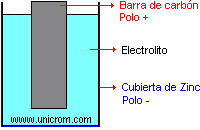
10.- Son los responsables de conducir la electricidad en los electrólitos:
A) átomos
B) iones
C) electrones
D) protones
11.-Es el cambio químico en el cual un ion, átomo o molécula aumenta su carga negativa (gana electrones).
A) Amortiguación
B) Neutralización
C) Reducción
D) Oxidación
12.- ¿Cuál de las siguientes formulas generales corresponde al compuesto orgánico denominado ácido carboxílico?
A) R-CO-H
B) R-CO-R
C) R-COO-CH3
D) R-COOH
13.- En la batería para automóvil el ánodo es de__________ y el cátodo de________
Sumergidos en una disolución de acido sulfúrico.
Selecciona la opción que completa correctamente el párrafo anterior.
A) zinc, cobre
B) zinc, grafito
C) cobre, grafito
D) plomo, dióxido de plomo
14.- Los núcleos atómicos con el mismo número de protones pero distinto número de neutrones se denominan:
A) isótopos
B) átomos
C) moléculas
D) iones
15.- ¿Cómo se le denomina a la cantidad de masa que se encuentra en una unidad de volumen?
A) Área
B) Cuerpo
C) Densidad
D) Porosidad
16.- Son responsables de conducir la electricidad en los metales:
A) átomos
B) iones
C) electrones
D) protones
sábado, 25 de abril de 2009
sábado, 1 de noviembre de 2008
sábado, 18 de octubre de 2008
"LOS GASES MISTERIOSOS"
ELECTRÓLISIS DEL AGUA.
JUSTIFICACÓN Y OBJETIVOS.
La Tierra, planeta azul. Tres cuartas partes de nuestro planeta están constituidas por agua, pero...
¿Qué sabemos de este apreciado “líquido transparente”?
Nuestra propuesta pretende:
• Demostrar experimentalmente la composición química del agua.
• Demostrar y explicar experimentalmente algunas propiedades físicas del agua.
Material necesario
• cuba electrolítica.
• Fuente de alimentación.
• Mangueras de plástico (Tubos de ensayo)
• Cerillos
• Agua y cloruro de sodio. (Sal de mesa)
Aplicación didáctica
La cuba electrolítica permite realizar la electrólisis del agua de una forma muy cómoda recogiendo los gases hidrógeno y oxígeno en cada uno de los tubos, el doble de hidrógeno que el de oxígeno.
El agua debe contener una pequeña cantidad de cloruro de sodio (sal) para mejorar su conductividad.
En la manguera conectada (o tubo de ensayo) en el electrodo del polo positivo se recoge oxígeno (-). Para comprobarlo podemos acercar la braza de un palillo. Veremos como el oxígeno aviva la llama e incluso a veces se vuelve a encender.
En la manguera conectada (o tubo de ensayo) en el electrodo del polo negativo se recoge hidrógeno (+). Para comprobarlo acercamos la llama de un cerillo y se escucha una explosión. Proponemos hacer la reacción inversa a la electrólisis del agua; la síntesis del agua. Se recogen los gases cambiando la polaridad de la corriente para mezclarlos por partes iguales en cada manguera cada 15 minutos o en su defecto cambiar las mangueras en el mismo lapso de tiempo o según lo decida lo importante es que sean partes iguales en ambas mangueras (O tubos de ensayo), se aplica corriente (energía de activación) y el hidrógeno reacciona con el oxigeno del aire produciendo un estallido peculiar:
2H2 (g) + O2 (g) → 2H2O ¡La famosa H2O!
La electrólisis del agua nos permite:
• Comprobar que el agua es un compuesto de hidrógeno y oxígeno.
• Ver la relación en la que se encuentran estos gases: 2 volúmenes de hidrogeno por 1 de oxígeno.
• Comprender la diferencia entre reacciones endotérmicas y exotérmicas.
• Comprender la diferencia entre reacciones de descomposición y de síntesis.
• Comprender las reacciones de oxido –reducción.
martes, 2 de septiembre de 2008
Suscribirse a:
Entradas (Atom)